|
|
Как была раскрыта тайна структуры атома Эрнест Резерфорд (1871–1937). Фото с сайта nobelprize.org Сто пятнадцать лет назад, в начале 1909 года (точную дату история не сохранила), только что получивший Нобелевскую премию профессор физики Манчестерского университета Эрнест Резерфорд случайно зашел в комнату, где его ассистент Ханс Гейгер работал со своим лаборантом старшекурсником Эрнестом Марсденом. Во время беседы Резерфорд дал юному тезке очень короткий совет, который запустил цепочку событий, приведших к одному из величайших открытий в истории физики двадцатого века — появлению концепции атомного ядра. Начало этой истории хорошо известно, а вот продолжение, которое пришлось на годы после Первой мировой войны, в основном забыто. Давайте ее восстановим без лакун и умолчаний. Кто вы, доктор Резерфорд?Эрнеста Резерфорда заслуженно называют отцом ядерной физики и одним из величайших физиков-экспериментаторов двадцатого столетия. Он первым понял, как устроен атом, первым идентифицировал протон как самостоятельную элементарную частицу (и дал ему имя) и первым же осуществил искусственную ядерную реакцию, превратившую азот в кислород. Исследования его учеников и сотрудников привели к изобретению ионизационного счетчика заряженных частиц (это сделал Ханс Гейгер), выявлению взаимосвязи между местом элемента в таблице Менделеева и спектром его рентгеновского излучения (Генри Гвин Мозли), созданию линейного ускорителя протонов и использованию его для расщепления атомного ядра и искусственного получения радиоактивных изотопов (Джон Кокрофт и Эрнест Уолтон), открытию нейтрона (Джеймс Чедвик), выделению гелия-3 и трития (сам Резерфорд, Марк Олифант и Пауль Хартек), получению сверхсильных магнитных полей (Петр Капица) — и это еще далеко не полный список. И хотя в старости Резерфорд не избежал тревог и разочарований, в молодые и зрелые годы он с полным правом мог считать себя баловнем фортуны. Однако была в жизни Резерфорда и еще одна совсем особая удача. Его крупнейший вклад в физику — планетарная модель атома, окончательно сложившаяся где-то в начале 1911 года. Чтоб ее сформулировать, помимо гениального прозрения была нужна исключительная смелость — ведь с точки зрения классической электродинамики Максвелла такой атом просто не мог существовать. Сей гордиев узел удалось разрубить лишь Нильсу Бору, который два года спустя с помощью квантовых представлений возвратил резерфордовскому атому право на жизнь. Резерфорд обосновал свою модель с помощью некой формулы, которую сам же и вывел и которая носит его имя. Однако же сегодня мы знаем, что предпосылки, которыми Резерфорд воспользовался для этого вывода, не соответствовали физической реальности. И все же в нее, как ни странно, прекрасно укладывались результаты экспериментов! Конечно, отсюда не следует, что здание величайшего открытия Резерфорда покоилось на песке, — по чистой случайности его фундамент оказался прочнейшим гранитом. В общем, отцу ядерной физики повезло совершенно особенным образом, о чем тогда никто и не догадывался. Но хватит намеков и иносказаний, перейдем к делу. Время РезерфордаЭрнест Резерфорд родился 30 августа 1871 года в городке Спринг Гроув (ныне — Брайтуотер) на Южном острове Новой Зеландии. В 1890 году он поступил на родине в Кентербери-колледж, а через 4 года получил стипендию для продолжения образования в Кембридже. В силу особого везения он оказался первым аспирантом-исследователем, кому недавно принятые новые правила разрешали продолжать образование в Кембридже, не заканчивая там основного курса. Он работал над диссертацией в знаменитой Кавендишской лаборатории, которую тогда возглавлял Джозеф Джон Томсон. В 1919 году Резерфорд сменил Томсона на этом посту и оставался директором лаборатории до последнего дня своей жизни — 19 октября 1937 года. Шесть дней спустя он был похоронен в Вестминстерском аббатстве. В Кембридже пришелец с берегов пролива Кука сначала занимался электромагнитными явлениями, и, в частности, собрал самый чувствительный в мире детектор электромагнитных волн с радиусом действия в несколько сотен метров, немного опередив и Попова, и Маркони. Он мог бы стать одним из изобретателей радио, но судьба распорядилась иначе. Томсон поручил Резерфорду исследование электропроводимости газов, ионизированных рентгеновскими лучами. В ходе этой работы Резерфорд задумался над механизмом образования ионов под действием тогда еще совершенно таинственного самопроизвольного излучения урана, которое французский физик Антуан Анри Беккерель обнаружил в феврале 1896 года. Выбор оказался судьбоносным — молодой физик на всю жизнь увлекся радиоактивностью и связанными с ней явлениями. Следует отметить, что в то время не существовало даже этого термина — Мария Склодовская-Кюри придумала его после того, как в 1898 году совместно со своим мужем Пьером Кюри открыла излучение тория.
 Джозеф Джон Томсон в своей лаборатории. Справа виден конец катодной трубки — инструмента, при помощи которого был открыт электрон. Конец 1890-х годов. Фото с сайта commons.wikimedia.org Это было замечательное время рождения новой науки о микромире. Когда Резерфорд работал у Томсона, тот положил начало эпохе поиска и идентификации субатомных объектов, совершенно неизвестных науке. В 1897 году он показал и двумя годами позже окончательно подтвердил, что катодные лучи представляют собой поток отрицательно заряженных частиц, масса которых в 2000 раз меньше массы атома водорода (подробности — в статье От корпускулы до электрона: кто, когда и как открыл первую элементарную частицу, «Элементы», 30.04.2022). Так состоялось открытие элементарной частицы №1 — электрона (это название немного позже предложил великий голландский физик Хендрик Антон Лоренц). А следующий шаг на этом пути вскоре сделал уже сам Резерфорд. В 1899 году он обнаружил, что уран испускает два вида излучения (как их тогда называли, эманации), и назвал их альфа- и бета-лучами. К тому времени он покинул Кембридж и работал в Канаде, в монреальском университете Макгилла. Там он оставался профессором физического факультета до мая 1907 года, после чего возвратился в Англию новоизбранным профессором физики теперь уже университета Манчестера, носившего тогда имя королевы Виктории. Интересно, что его предшественник на этой кафедре, известный в свое время физик немецкого происхождения Артур Шустер, предложил руководству университета добровольно выйти в отставку ранее положенного по возрасту срока — но только при условии, что его сменит Резерфорд.
В Канаде Резерфорд познакомился и подружился с Фредериком Содди, тогда лаборантом-демонстратором химического факультета, а в будущем известным радиохимиком и Нобелевским лауреатом по химии 1921 года. В ходе совместной работы они развили концепцию радиоактивности как внутреннего свойства некоторых атомов, которое не зависит ни от состава соединений, в чьи молекулы они входят, ни их физического окружения. В дальнейшем эта идея стала основой теоретического понимания радиоактивности. Именно Резерфорд и Содди экспериментально доказали, что интенсивность радиоактивных излучений любых источников всегда уменьшается со временем по закону геометрической прогрессии — иначе говоря, падает экспоненциально (E. Rutherford, F. Soddy, 1903. A Comparative Study of the Radioactivity of Radium and Thorium). В Монреале Резерфорд также занимался движением альфа-частиц в электростатических и магнитных полях. Эти эксперименты позволили измерить отношение заряда альфа-частицы к ее массе и предварительно отождествить ее с полностью ионизированным атомом гелия. Были у него в это время и другие работы, на которых я не стану останавливаться, — это потребовало бы совсем другого формата, поскольку в Кембридже и Монреале Резерфорд опубликовал около четырех десятков оригинальных статей. Остается добавить, что в 1903 году он стал членом Королевского общества, а двумя годами позже получил очень престижную медаль Румфорда. Перебравшись в Манчестер, Резерфорд унаследовал от Шустера не только профессуру, но и новую и хорошо оснащенную лабораторию, а также очень способного и работоспособного ассистента. Это был Ханс Гейгер, который в 1906 году приехал из Германии после защиты докторской диссертации по математике в Эрлангенском университете. Под руководством нового шефа Гейгер сделал себе вполне самостоятельное имя в физике, в частности, изобрел счетчик заряженных частиц, который и посейчас носит его имя.
 Резерфорд с сотрудниками из Манчестерского университета, 1910 год. В первом ряду по центру сидят Артур Шустер (слева) и Эрнест Резерфорд. Также на фото присутствуют Эрнест Марсден (верхний ряд, второй справа) и Ханс Гейгер (средний ряд, второй справа). Фото с сайта history.aip.org Но вернемся к тем видам радиоактивной эманации, которые открыл Резерфорд. Природа бета-лучей выяснилась уже в 1899 году, когда Фриц Гизель (Fritz Giesel), Беккерель и Мария Кюри пришли к заключению, что это просто быстрые электроны. Проблему альфа-частиц окончательно разрешил сам Резерфорд в счастливом для себя 1908 году, принесшем ему Нобелевскую премию по химии. Он вместе с Томасом Ройдсом (Thomas Royds) доказал, что там, где присутствует источник альфа-излучения, появляются атомы гелия, что подтвердило его монреальскую гипотезу (E. Rutherford, T. Royds, 1909. The Nature of the α Particle from Radioactive Substances). А в интервале между этими событиями, в первый год XX века, француз Поль Виллар открыл у урана еще один вид излучения, которое тот же Резерфорд обозначил гаммой, третьей буквой греческого алфавита. В 1910 году английский физик Уильям Генри Брэгг доказал, что гамма-лучи представляют собой электромагнитные волны. Четырьмя годами позже Резерфорд и его ассистент Эдвард Невил да Коста Андраде (Edward Andrade) впервые измерили длины их волн и продемонстрировали, что они намного меньше длин волн рентгеновского излучения. Для описания всех работ Резерфорда, связанных с изучением радиоактивности, мне просто не хватит места. Однако через два года после возвращения в Англию он радикально обновил свою исследовательскую программу. Еще в Канаде он начал догадываться, что альфа-частицы можно использовать для зондирования структуры атомов, однако занялся этим на практике уже в Манчестере. Атомные моделиИдея Резерфорда родилась не на пустом месте. В те времена уже существовали конкурирующие физические модели, описывавшие строение атома, и Резерфорд скорее всего полагал, что задуманные им эксперименты послужат их экспериментальной проверкой. Так и получилось — однако с неожиданным результатом. Все модели, о которых идет речь, имели всего несколько лет отроду — и не случайно. На протяжении XIX века атомами занимались в основном химики. Им не было особого дела до тонкостей атомной структуры, поскольку вполне достаточно было знать, как ведут себя атомы и молекулы в различных химических реакциях. Что же до физики, то она еще не располагала никакими экспериментальными сведениями об субатомных частицах. Все изменилось после открытия электрона. Физики получили в свое распоряжение бесспорный компонент атома, и от этой печки можно было начать танцевать. Первым это проделал сам Дж. Томсон. В 1898 году он смоделировал атом в виде нафаршированного электронами шарика из положительно заряженной материи, который немедленно назвали «сливовым пудингом». Предполагалось, что в основном, невозбужденном состоянии атома электроны покоятся, а в возбужденном совершают гармонические колебания, вызывающее излучение электромагнитных волн. Сначала Томсон допускал, что электронная заселенность атома может исчисляться сотнями и даже тысячами. В 1906 году анализ рассеяния рентгеновских лучей в газах привел его к совершенно правильному выводу, что число электронов в атоме лежит в интервале 0,2–2 его атомного веса. «Пудинговая» модель объясняла кое-какие опытные факты, но изначально была мертворожденной. Погубил ее английский математик Сэмюэль Ирншоу, живший задолго до Томсона. В 1842 году он доказал, что система покоящихся постоянных магнитов не может находиться в статическом равновесии. Поскольку это утверждение легко распространяется и на электрические заряды, из него вытекает, что атом Томсона в основном состоянии существовать не может. Чтобы преодолеть это затруднение, Томсон в 1904 году предположил, что электроны вращаются внутри атома, обретая тем самым дополнительную энергию. Правда, оставалось непонятным, почему положительная материя «пудинга» не тормозит это вращение, но это еще не самое серьезное возражение. Согласно классической электродинамике, электроны (как и любые заряженные тела) при любом непрямолинейном (следовательно, и вращательном) движении излучают электромагнитные волны. В результате они теряют энергию, а атом — стабильность. При всех этих недостатках модель Томсона доминировала в течение нескольких лет — как из-за авторитета ее создателя, так и благодаря отсутствию серьезных соперников. Правда, кое-какие конкуренты у нее имелись. В 1903 году немецкий физик Филипп Ленард предположил, что атом состоит из так называемых динамид, попарно связанных положительных и отрицательных зарядов равной массы (в современной терминологии, диполей), разделенных пустым пространством. Годом позже японец Хантаро Нагаока увидел в атоме подобие Сатурна: кольца из тысяч электронов, вращающиеся вокруг центрального ядра (ранее нечто в этом роде предложил английский физик Оливер Лодж). Модели Ленарда и Нагаоки были весьма умозрительными и очень обоснованно критиковались. Например, в том же 1904 году британский математик Джордж Шотт (George Schott) на базе максвелловской электродинамики показал, что кольца Нагаоки должны практически мгновенно разрушаться. Тем не менее, Резерфорд их хорошо знал и серьезно обдумывал. Эксперимент и формулаНо вернемся к альфа-частицам. В 1908 году Венская академия наук заимообразно передала Резерфорду 250 миллиграммов радия, что по тем временам было очень большим количеством. Однако концентрация чистого радия в полученном препарате была невелика, поэтому Резерфорд использовал его в качестве источника альфа-радиоактивного газа, который тогда называли эманацией радия, а сейчас именуют радоном. Для этого он изобрел и построил специальный аппарат, который позволил собирать радон и накапливать его в стеклянных пробирках. Продолжая эти эксперименты, он окончательно доказал тождество альфа-частиц и ионизированных атомов гелия, о чем говорилось выше. Но самое интересное было впереди. Ключевая идея Резерфорда состояла в детектировании альфа-частиц благодаря их способности вызывать вспышки на экране, покрытом сцинтиллирующим веществом. В 1908 году он, работая вместе с Гейгером, пришел к заключению, что каждая альфа-частица порождает на сцинцилляторе свою собственную одиночную вспышку. Этот результат стал основой очень успешного исследовательского метода. В том же году Гейгер таким способом изучил рассеяние альфа-частиц на тонких пленках из золота и алюминия. Оказалось, что некоторые из налетающих частиц отклонялись на необычно большие углы, что тогда не поддавалось объяснению. Это сообщение было опубликовано (H. Geiger, 1908. On the scattering of the α-particles by matter), но особого внимания не привлекло. Однако это было только начало. На следующий год у Гейгера появился студент-помощник, двадцатилетний уроженец Манчестера Эрнест Марсден. Как-то Резерфорд вспомнил странные результаты Гейгера и предложил Марсдену детальней изучить отражение альфа-частиц от металлических поверхностей. Как потом вспоминал Марсден, профессор вряд ли ожидал от таких экспериментов чего-то интересного, однако его совет оказался поистине судьбоносным. Марсден спроектировал экспериментальную установку и сам же ее изготовил. Это была герметичная свинцовая камера, внутри которой лежал кусочек радия, который, как ему и положено, порождал радон, также обладающий альфа-радиоактивностью. Испускаемые этим источником альфа-частицы проходили через узкое отверстие в свинцовой пластине, вырезавшее умеренно коллимированный пучок, который падал на мишень из тончайшей золотой фольги. В камере имелся покрытый сернистым цинком передвижной экран, испускавший под ударами альфа-частиц очень слабые вспышки света. Изменяя положения экрана, можно было регистрировать частицы, отразившиеся от мишени под любым углом. Вспышки наблюдались через окошко в стенке камеры с помощью 50-кратного микроскопа. Перед началом очередной серии наблюдений из камеры выкачивали воздух.
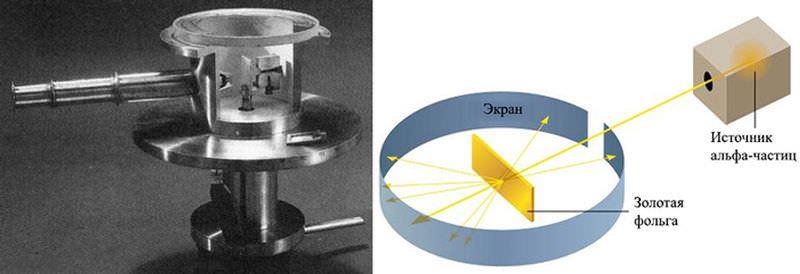 Установка, при помощи которой Гейгер и Марсден измеряли рассеяние альфа-частиц на золотой фольге. Слева — фото реплики оригинального прибора (часть стенки удалена, чтобы показать внутреннее устройство; трубка, торчащая влево, — микроскоп для наблюдения за вспышками от рассеянных альфа-частиц на экране), справа — схема эксперимента. Изображения с сайтов en.wikipedia.org и physicsopenlab.org Марсден приступил к эксперименту в одиночку, но к нему вскоре подключился Гейгер. В первое время они помещали сцинтиллирующий экран только позади мишени, поскольку из модели Томсона следовало, что альфа-частицы должны рассеиваться в фольге очень слабо. Поначалу казалось, что результаты полностью соответствуют этим ожиданиям: частицы-снаряды легко пронизывали фольгу, лишь незначительно изменяя направления (позже Гейгер вычислил, что наиболее вероятный угол рассеяния при толщине фольги 0,4 микрона составляет 0,87 градуса). На этом эксперимент мог бы и закончиться, но Резерфорд как-то предложил посмотреть, не уходят ли альфа-частицы на большие углы. Позже он вспоминал, что не слишком верил в эту возможность, но правда ли это, еще вопрос. Как бы то ни было, вскоре произошло то, что Резерфорд назвал самым невероятным событием своей жизни. Оказалось, что некоторые очень немногочисленные альфа-частицы (порядка сотой доли процента) не только рассеиваются перпендикулярно первоначальному направлению пучка, но даже отбрасываются назад. Модель Томсона такого практически не допускала. По словам Резерфорда, это было все равно, как если бы пятнадцатидюймовый снаряд отразился от бумажной салфетки («almost as incredible as if you fired a 15-inch shell at a piece of tissue paper and it came back to hit you»).
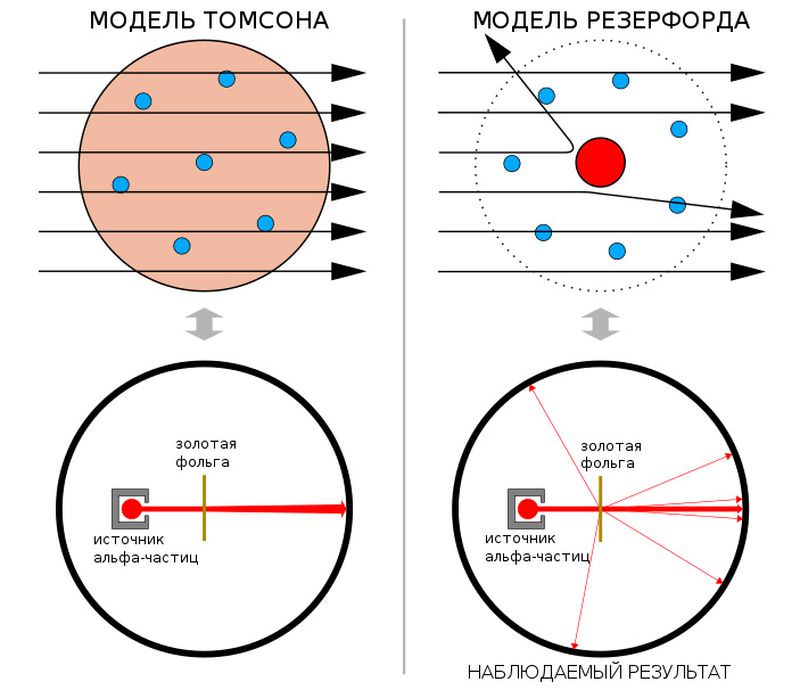 Предсказание результатов эксперимента Гейгера — Марсдена по рассеянию альфа-частиц в рамках моделей Томсона (слева) и Резерфорда. В «пудинговой» модели Томсона альфа-частицы проходят сквозь атом почти без рассеяния. Модель атома Резерфорда, в которой атом имеет маленькое плотное ядро с положительным зарядом, предсказывает, что некоторая часть альфа-частиц будет отклоняться на значительные углы. Рисунок с сайта ru.wikipedia.org Результаты Гейгера и Марсдена были быстро опубликованы (H. Geiger, E. Marsden, 1909. On a diffuse reflection of the α-particles), но и они особого впечатления ни на кого не произвели. А вот Резерфорд погрузился в раздумья. В течение всего 1910 года он пытался подобрать для них объяснение, но задача оказалась трудной. Однако в декабре Резерфорд написал американскому радиохимику Бертраму Болтвуду, что рассчитывает вскоре предложить новую модель атома, много лучшую, нежели томсоновская. Впервые он ее представил публике 7 марта 1911 года на заседании Манчестерского литературно-философского общества. Тогда же он подготовил и в мае уже опубликовал статью с подробным анализом результатов своих сотрудников и других ученых, полученных при исследовании рассеяния альфа-частиц и электронов на различных металлах (E. Rutherford, 1911. The scattering of α and β particles by matter and the structure of the atom). В конце этой работы он констатировал, что «при рассмотрении данных в целом, по-видимому, наиболее простым является предположение, что атом имеет центральный заряд, распределенный по очень малому объему» («Considering the evidence as a whole, it seems simplest to suppose that the atom contains a central charge distributed through a very small volume»). По оценке Резерфорда, центральный заряд был упакован внутри сферы, радиусом менее 3×10−12 см. Это и была первоначальная формулировка резерфордовской модели атома. Центральный заряд он еще не называл ядром — этот термин он впервые использовал только на следующий год. В статье также нет и речи о том, что электроны обращаются вокруг ядра наподобие планет. Этот вопрос Резерфорд до поры до времени оставил открытым — и вовсе не случайно. Такое допущение сразу вызвало бы те самые возражения, с которыми не могла справиться модель Томсона — атом с вращающимися электронами был обязан мгновенно разрушиться. Поэтому не удивительно, что в эти дебри Резерфорд лезть не захотел, ведь его гипотеза и так уже опрокинула общепринятые представления о структуре атома.
Резерфорд не смог бы обосновать столь революционный вывод лишь указанием на экспериментальный факт рассеяния альфа-частиц на большие углы — коллегам-физикам требовались более веские аргументы. Тут-то гениальный экспериментатор и выступил в роли первоклассного теоретика. Объединив уравнения ньютоновской механики с законом Кулона, он вычислил, с какой вероятностью заряженная частица при движении в поле точечного заряда отклоняется на определенный угол от первоначального направления. Это и была знаменитая формула Резерфорда, впервые опубликованная в этой же статье. Точный ее вид приводить не обязательно, достаточно сказать, что искомая вероятность обратно пропорциональна четвертой степени синуса половины угла рассеяния. Данные Гейгера и Марсдена прекрасно укладывались в эту математическую зависимость. Ни одна из конкурирующих моделей атома не смогла предложить столь же сильного доказательства своей справедливости. Парадокс и его объяснениеА теперь мы подошли к моменту истины. Рассеяние испущенных радием или радоном альфа-частиц на атомных ядрах — это чисто квантовый процесс. Для его описания хватит уравнения Шредингера, поскольку альфа-частицы в данном случае движутся с нерелятивистскими скоростями. Однако в 1911 году физика до этого уравнения еще не дошла. В частности, сечение такого рассеяния в общем случае зависит от спинов сталкивающихся частиц, а в классической физике этого понятия вообще не существует. Так почему же формула Резерфорда так хорошо согласовалась с экспериментом? Затруднение со спинами объяснить не так уж сложно, поскольку альфа-частицы их не имеют, но как быть с квантовой механикой в целом? Оказывается, для бесспиновых частиц решение уравнения Шредингера дает ту же формулу, что и уравнение Ньютона, если рассеяние происходит за счет центральной силы, величина которой обратно пропорциональна квадрату расстояния! Именно таково кулоновское взаимодействие двух точечных электрических зарядов. При любом другом потенциале классическая и квантовая механика дают различные результаты. Поэтому-то справедливость формулы Резерфорда для рассеяния альфа-частиц на металлической фольге оказалась лишь очень счастливой случайностью. Как известно, история не терпит сослагательного наклонения, но поиграть с ним приятно. А что, если бы природа распорядилась иначе, и результаты измерений Гейгера и Марсдена не уложились в резерфордовскую формулу, хотя с точки зрения тогдашних физических представлений она и была совершенно безупречной? В этом случае Резерфорд мог бы и не предложить своей модели, которая и так откровенно выламывалась из электродинамики Максвелла. А тогда не было бы и трех гениальных статей Бора 1913 года с квантовой теорией одноэлектронного атома и ее расширением на многоэлектронные атомы и молекулы. Конечно, в конце концов эти проблемы были бы разрешены, но кем, когда и как, можно только гадать. Короче говоря, резерфордовская фортуна сильно поторопила появление на свет квантовой механики. Ближайшее продолжениеВ годы перед Первой мировой войной Резерфорд выполнил в Манчестере еще немало исследований, которые я опять-таки оставлю за кадром. А вот к ее концу судьба вновь послала Резерфорду в полном смысле великое открытие. В 1914 году Марсден изучал прохождение альфа-частиц через емкость с водородом, которое приводило к «выбиванию» атомов этого газа во внешнее пространство. В этом не было ничего необычного, такой эффект и ожидался. Однако в следующей серии опытов альфа-частицы проходили уже не через водород, а через обычный воздух. Можно было ожидать, что во второй серии число таких вспышек резко упадет, поскольку содержание водорода в воздухе составляет малые доли процента. Поскольку этого не случилось, Марсден решил, что здесь работает какой-то новый механизм генерации частиц водорода — какой именно, он не знал. Вскоре он уехал преподавать в Новую Зеландию, а потом был мобилизован в армию, так что этих наблюдений не продолжил. В 1917–1918 годах Резерфорд — замечу, с разрешения Марсдена! — занялся этой загадкой, причем делал это очень нерегулярно — мешали исследования для военных целей. Он предположил, что какую-то роль в замеченной Марсденом аномалии могут играть атомы основного компонента воздуха, то есть азота. Придя к этой мысли, Резерфорд осуществил в своей манчестерской лаборатории простой, но очень эффективный эксперимент, который подтвердил его гипотезу. В итоге он пришел к заключению, что при прохождении альфа-частиц, испущенных так называемым веществом RaC (в современной терминологии, это был радиоактивный изотоп висмута) через емкость с азотом молекулы этого газа порождают, как это сформулировал Резерфорд, «либо атомы водорода, либо другие атомы с массовым числом 2». В то время подобный результат выглядел весьма парадоксально. Сейчас мы знаем, что великий физик осуществил ядерную реакцию превращения азота в кислород N147 + He42 = O178 + H11, но до такого понимания этого процесса тогдашняя физика еще не дошла. Первым этом вывод в 1924 году сделал ученик Резерфорда Патрик Блэкетт, который наблюдал и фотографировал следы этой реакции в камере Вильсона. Стоит отметить, что обнаруженный Блэкеттом по треку в вильсоновской камере изотоп кислорода с атомным весом 17 тогда еще не был известен науке. Своим экспериментом Блэкетт опроверг уверенность Резерфорда в том, что обстрел азота альфа-частицами рождает изотоп углерода. После этого уточнения вернемся к эксперименту Резерфорда. В то время своим главным результатом он счел доказательство того, что, поскольку атомы азота при столкновениях с быстрыми альфа-частицами распадаются и высвобождают атомы (точнее, как он сам отмечал, ядра) водорода, те входят в состав ядер азота в качестве составных частей. Свои наблюдения и теоретические выводы он представил в четырехчастной статье, опубликованной на следующий год после окончания войны (E. Rutherford, 1919. Collisions of alpha-particles with light atoms). Эта статья очень богата по содержанию — как по тому, которое выражено открытым текстом, так и по тому, которое читается между строками. Резерфорд пришел к заключению, что ядра водорода надо считать такими же основными компонентами вещества, как электроны и альфа-частицы. Второе следствие его открытия состоит в том, что помимо естественного радиоактивного распада, оказалось возможно и искусственное расщепление элементов, не обладающих природной радиоактивностью. Третье следствие: как писал Резерфорд, «мы имеем все основания полагать, что α-частица имеет сложную структуру и, вероятно, состоит из четырех ядер водорода и двух отрицательных электронов». Наконец, было также и четвертое: рассеяние альфа-частиц не всегда подчиняется знаменитой резерфордовской формуле, о которой шла речь выше. В ретроспективе его смысл очевиден: ядерные силы управляются не классической, а квантовой механикой, и уже поэтому отличаются от кулоновских. Конечно, до такого понимания физика еще должна была дойти. Как уже говорилось, в 1919 году Резерфорд стал преемником Дж. Томсона в Кавендишской лаборатории. Там он вместе с помощниками поставил ряд новых экспериментов по расщеплению азота и кислорода, которые фактически привели его к мысли о существовании тяжелого изотопа водорода, а также нейтральной частицы, равной по массе ядру водородного атома. В современной терминологии это дейтрон и нейтрон, однако открыть их было суждено уже другим ученым. Наконец, в августе 1920 года он придумал и огласил на состоявшейся в Кардиффе конференции Британской ассоциации в поддержку науки специальное названия для ядра водорода — протон. Вообще-то он сделал это не по собственной инициативе, а с подачи Оливера Лоджа, который тогда попросил его дать отдельное имя заряженному ядру водорода, чтобы избежать его путаницы с нейтральным атомом этого элемента. Это лингвистическое нововведение быстро вошло в язык физики. Поскольку Резерфорд уже пришел к выводу о составной структуре альфа-частиц, истинно элементарными компонентами материи он счел только два — протон и электрон. Кстати, в этом он был не оригинален: гипотезу о том, что атомные ядра состоят из ионов водорода и электронов еще в 1914 году высказал голландский юрист и физик-любитель Антониус ван ден Брук. Конечно, были еще и эйнштейновские световые кванты (термин «фотон» появился только в 1926 году), но они считались частицами электромагнитного излучения, а не вещества. В заключение этого раздела совершу небольшой скачок во времени. В феврале 1932 года любимый ученик Резерфорда и будущий нобелевский лауреат Джеймс Чедвик открыл нейтральную частицу, чуть-чуть превосходящую по массе протон. Тогда он счел ее композитом протона и электрона, то есть, именно той внутриядерной структурой, которую в 1920 году предсказал Резерфорд, назвав ее нейтроном. Он и дальше какое-то время придерживался именно этой концепции, как и ряд других физиков. Насколько мне известно, первым, кто счел нейтрон такой же элементарной частицей, как и протон, был молодой советский физик Дмитрий Дмитриевич Иваненко. В конце мая 1932 года он предложил эту гипотезу в очень короткой (приблизительно на пятую часть журнальной страницы) заметке в Nature (D. Iwanenko, 1932. The neutron hypothesis). Однако тогда он представил читателям журнала свою идею только в форме вопроса: «Основной интерес состоит в том, в какой степени нейтроны можно считать элементарными частицами наподобие протонов и электронов» («The chief point of interest is how far the neutrons can be considered as elementary particles (something like protons or electrons).»). Только в августе Иваненко детально сформулировал свое понимание роли нейтронов и протонов в структуре атомных ядер в статье, опубликованной во Франции по рекомендации Луи де Бройля (D. Iwanenko, 1932. Sur la constitution des noyaux atomiques). К этому времени в печати уже появилась большая статья Вернера Гейзенберга, в которой протонно-нейтронная модель ядра была описана весьма детально, а среди ссылок содержалась и заметка Иваненко в Nature (W. Heisenberg, 1932. Über den Bau der Atomkerne). Согласно некоторым воспоминаниям, к этому предположению примерно тогда же независимо пришел ученик Ферми Этторе Майорана. Не могу сказать, так ли было в действительности, но Майорана, во всяком случае, ничего на сей счет не опубликовал. Однако окончательно равноправность этих частиц была признана только после того, как Энрико Ферми в 1934 году обнародовал свою гениальную теорию бета-распада, где они фигурировали именно в этом качестве. Конечно, мы давно не считаем их элементарными — со времени создания Марри Гелл-Маном и Джорджем Цвейгом кварковой модели. Но это уже к делу не относится. Непростые 1920-еВ военное время и сразу после Резерфорд и его помощники практически монопольно снабжали международное научное сообщество результатами иследований физики ядра. Однако уже с начала 1920-х годов ситуация стала меняться. В Вене в 1910 году был открыт первый в мире Институт по исследованию радия (Institute for Radium Research), который организовал и с самого начала фактически возглавил блестящий физик Стефан Мейер (Stefan Meyer), бывший ассистент великого Людвига Больцмана (формально должность директора он занял в 1920 году, ранее им считался ректор Венского университета Франц Серафин Экснер). В довоенное время оттуда постоянно разлеталась по всему миру разнообразная и хорошо выверенная информация о конкретных свойствах различных радиоактивных элементов и их изотопов. Мейер и его заместитель Карл Прибрам нашли возможность и во время войны продолжить работу института почти что на прежнем уровне (этому сильно помогло то, что Богемия с ее урановой рудой в Иоахимстале тогда была частью Австро-Венгерской империи). Когда после войны международные связи института постепенно восстановились, у исследователей из Кавендиша появился конкурент. К середине 1920-х годов работавший в Вене шведский физик и будущий крупный океанограф Ханс Петтерсон (Hans Pettersson), его ближайший помощник Герхардт Кирш и их коллеги выступили соперниками кембриджцев в исследовании и интерпретации искусственного расщепления атомных ядер с помощью альфа-частичного обстрела. Результаты, о которых они сообщали в научных журналах, во многом противоречили материалам группы Резерфорда. Это касалось данных по бомбардировке бериллия, магния и кремния, но прежде всего углерода, где расхождение было особенно очевидным. Петтерсон и Кирш сообщали, что им удалось наблюдать распад ядер этого элемента с испусканием протонов, в то время как в Кавендише ничего такого не видели. Споры по этому поводу тянулись несколько лет, но в 1927–28 годах результаты Петтерсона и Кирша были признаны несостоятельными. Эта история получила огласку и сильно подорвала международный авторитет института Мейера. Казалось бы, что Резерфорд и работавший вместе с ним Джеймс Чедвик могли торжествовать, поскольку их отчеты выдержали все проверки. К тому же Резерфорд смог объяснить (точнее, интерпретировать) эти данные на основе своей новой модели атомных ядер и процессов естественной и искусственной радиоактивности. Ядро, по Резерфорду, состояло из сложенной из протонов положительно заряженной центральной части, окруженной облаком вращающихся вокруг нее электронов и внешнего кольца «нейтральных α-частиц», как их называл Резерфорд, занимающих собственные квантованные орбиты. Резерфорд в данном случае имел в виду лишенные электрического заряда гипотетические комплексы из четырех протонов и четырех электронов. Если по каким-то причинам, относительно которых Резерфорд не высказывался, такой комплекс потеряет два электрона, он обретет двойной положительный заряд, оттолкнется от положительно заряженной сердцевины и вылетит наружу в виде обычной альфа-частицы — вот вам и объяснение альфа-радиоактивности. Аналогично, какой-то из потерянных электронов может точно так же отразиться от внутреннего электронного кольца и тоже покинуть ядро — и это будет бета-радиоактивность. Обращающиеся на периферии ядра нейтральные альфа-частицы могут перескакивать с внешних орбит на внутренние, испуская высокочастотные фотоны, подобно электронам в атоме Бора — так Резерфорд разделался и с гамма-радиоактивностью. Наконец, по мысли Резерфорда, столкновение ядра с приходящими извне альфа-частицами нарушает его стабильность и вызывает трансмутации, которые сопровождаются вылетом протонов. Конечно, это были чисто качественные рассуждения, но в контексте тогдашней микрофизики они все же как-то смотрелись. Вся эта схема была представлена в большой статье, опубликованной в 1927 году (Ernest Rutherford, 1927. Structure of the Radioactive Atom and Origin of the α-Rays). Сходные идеи Резерфорд высказывал и в других работах конца 1920-х — начала 1930-х годов. Их можно найти и в его совместных публикациях с Джеймсом Чедвиком, которые я не буду обсуждать. Но имелись и осложнения. Чедвик в начале Первой мировой войны оказался в Германии, где работал в лаборатории Гейгера в Имперском Физико-техническом институте, расположенном в берлинском пригороде Шарлоттенбурге. Именно там он в начале 1914 года обнаружил, что спектр бета-излучения смеси радиоактивных изотопов висмута и свинца с атомным весом 214 состоит из двух компонентов — линейчатого и непрерывного. Наличие непрерывного спектра в 1920 годы вызвало хорошо известный кризис понимания бета-радиоактивности, который в конце концов привел Вольфганга Паули к выдвижению его знаменитой гипотезы об участии в этом процессе неизвестной науке незаряженной частицы очень маленькой массы. Что до Чедвика, то он не успел уехать до начала боевых действий и потому попал в лагерь для интернированных граждан враждебных стран. Впрочем, ему еще повезло — другой сотрудник лаборатории Гейгера, блестящий физик и тоже будущий нобелевский лауреат Вальтер Боте, который воевал на русском фронте, в 1915 году попал в плен и конец войны встретил в сибирском лагере. Вернувшись в Англию, Чедвик вновь «подключился» к своему великому учителю и шефу. В 1920 году Чедвик вместе c работавшим в Кавендише канадским физиком швейцарского происхождения Этьеном Билером (Étienne Biéler) повторил резерфордовские эксперименты по рассеянию альфа-частиц, используя улучшенную технику наблюдений. Они пришли к выводу, что либо резерфордовская гипотеза о структуре альфа-частицы (четыре ядра водорода и два электрона) неверна, либо альфа-частицы скреплены таким взаимодействием между своими компонентами, которое не подчиняется кулоновскому закону обратных квадратов. Чедвик и Билер не только сочли более вероятной вторую возможность, но также отметили, что она ставит на повестку дня поиск правильной пространственной зависимости силового поля альфа-частиц, которую пока что невозможно определить на основе уже выполненных экспериментов (J. Chadwick, E. Bieler, 1921. The collisions of α particles with hydrogen nuclei). Позднее Билер в статьях 1923 и 1924 годов высказал мнение, что для объяснения устойчивости альфа-частиц надо ввести взаимодействие, обратно пропорциональное третьей или четвертой степени радиуса. Резерфорд пошел даже дальше и в конце концов склонился к опубликованной в 1926 году версии Петера Дебая, который вместе со своим соавтором В. Хардмейером предположил пятую степень, обусловленую специфическими поляризационными эффектами. Когда Дж. Дж. Томсон на семинаре Кавендишского физического общества указал Резерфорду, что законы классической механики не допускают стабильных орбит в таких силовых полях, Резерфорд ответил, что для квантовой механики это ограничение не обязано работать. Я не уверен, что эту фразу можно считать предвидением неизбежности перехода к квантовой механике при рассмотрении ядерной материи, — вполне возможно, что великий физик попросту ушел от ответа. Впрочем, стоит также отметить, что гипотезу о главенстве квантовых закономерностей в управлении свойствами атомных ядер в любом случае первым высказал не Резерфорд, а Арнольд Зоммерфельд — еще в 1919 году. Как бы то ни было, во второй половине 1920-х годов вполне могло показаться, что всегдашнее везение Резерфорда вновь ему не изменило. Во всяком случае, он сам был вполне убежден, что события последних лет полностью реабилитировали его теорию атомных ядер и внутриядерных сил. Вскоре выяснилось, как сильно он в этом ошибался. Но это уже совсем другая история, на которой я остановлюсь позже. В заключение этого раздела надо объяснить, в чем же состояли ошибки венских физиков. Если не вдаваться в детали, то их главная слабость была в недостаточной отработке методики визуальной регистрации сцинтилляционных вспышек с помощью специальных микроскопов. В Кавендише эта техника была отточена многолетней практикой до мельчайших деталей. Причем, что немаловажно, все наблюдения проводились либо лично Резерфордом и Чедвиком, либо под их плотным контролем. А вот Петтерсон и Кирш в значительной степени передоверили эту функцию женщинам-наблюдателям, которые работали счетчиками вспышек (Петтерсон почему-то считал, что они по психофизиологическим причинам действуют в этом качестве лучше мужчин). И дело не в том, что Петтерсону достались плохие помощницы. Все три его ассистентки уже были вполне состоявшимися исследователями с докторскими степенями, которым были суждены успешные научные карьеры. Болгарка по отцу и англичанка по матери Елизавета (Элизабет) Карамихайлова в тридцатые годы работала в Кавендише, позднее стала доцентом кафедры экспериментальной атомистики и радиоактивности Софийского университета, а со временем получила звание профессора Болгарской академии наук. Ее коллега Мариетта Блау в 1919 году в 24-летнем возрасте заработала в Венском университете докторскую степень за пионерскую разработку метода детектирования заряженных частиц с помощью фотоэмульсий. Этот метод позднее много раз с успехом применялся другими исследователями — например, именно с его помощью Сесил Пауэлл вместе с тремя коллегами в 1947 году открыл пионы, за что три года спустя был вознагражден Нобелевской премией. В 1937 году Блау и ее ученица Герта Вамбахер стали лауреатами весьма уважаемой в Австрии премии Либена, которой до них была награждена (в 1925 году) только одна женщина, замечательный физик Лизе Мейтнер. После аншлюса Блау уехала сначала в Мексику, а потом в США, где занималась исследованиями в Колумбийском университете, Брукхейвенской национальной лаборатории и университете Майами. Вернувшись в 1960 году в Австрию, она еще четыре года проработала в Институте по исследованию радия, где получила от Австрийской Академии наук премию имени Эрвина Шредингера. Венгерский радиохимик Элизабет Рона, третья ассистентка Петтерсона, еще много лет была ассистенткой Мейера, а в 1941 году приехала в США, где работала в вашингтонском Тринити-колледже, в Аргоннской национальной лаборатории и в Ок-Риджском институте ядерных исследований. В лаборатории Петтерсона они трудились честно и с полной отдачей, но вот методика их подвела. И последнее. Петтерсон и Кирш совершенно не верили в модель Резерфорда 1927 года, считая ее чисто умозрительной и мало что объясняющей. Они видели в распаде ядра под действием соударения с альфа-частицей нечто вроде химического взрыва. Хотя эта аналогия с современной точки зрения тоже неверна, она все же ближе к истине, нежели гипотеза Резерфорда. В этом можно видеть одну из многих гримас истории науки. Квантовый прорывСтатья Резерфорда Structure of the Radioactive Atom and Origin of the α-Rays стала его высшим достижением в теоретической ядерной физике (в отличие от физики атома!). Однако в силу еще одной исторической гримасы она стимулировала рождение конкурирующей парадигмы в этой области науки, которая вскоре одержала решительную победу. Я расскажу только о самом начальном этапе ее формирования — описание следующих выходит за рамки этой статьи. Этот этап географически связан с двумя научными центрами — Физическим институтом Геттингенского университета и Палмеровской лабораторией Принстона. Начну с первого. В 1920-е годы его возглавлял один из основателей квантовой механики Макс Борн, который сменил на этом посту Петера Дебая. Летом 1928 года туда приехал на стажировку недавний выпускник Лениградского университета Георгий Гамов. К тому времени он настолько освоил только что появившуюся квантовую механику, что дал самостоятельную и весьма элегантную формулировку гейзенберговского принципа неопределенности. Едва ли не на следующий день после прибытия ему попалась в библиотеке только что упомянутая статья Резерфорда. Гамов практически мгновенно понял, что резерфордовская модель радиоактивности не выдерживает критики и что для настоящего объяснения этого процесса необходимо привлечь аппарат новой физики. Вычисления не заняли много времени, если не считать заминки с одним интегралом, который по просьбе Гамова посчитал находившийся тогда в Геттингене математик и механик Николай Евграфович Кочин, в будущем действительный член АН СССР. Уже 29 июля Гамов послал в немецкий физический журнал статью, в которой рассмотрел вылет альфа-частицы из радиоактивного ядра как процесс квантового туннелирования. Она была опубликована в октябре в Zeitschrift für Physik (G. Gamov, 1928. Zur Quantentheorie der Atomkernes). В том же году появились еще две гамовские статьи — первая опять в Zeitschrift für Physik, вторая в Nature. За ними последовали другие важные публикации — например, обсуждение модели атомного ядра, которая позднее была названа капельной (G. Gamov, 1930. Mass Defect Curve and Nuclear Constitution). Но я сейчас пишу не о Гамове. Гамовская теория настолько общеизвестна, что вдаваться в ее физические детали просто не имеет смысла, — тем более, что расчеты по квантовому туннелированию можно найти практически в любом курсе квантовой механики. Я только отмечу, что Ганс Бете в 1937 году назвал ее первым успешным приложением квантовой теории к ядерным явлениям. Но в этом великий физик ошибся. 22 сентября 1928 года в журнале Nature в разделе писем к редактору появилась короткая (объемом менее страницы) заметка двух американских физиков, отправленная в редакцию всего лишь днем позже работы Гамова (R. Gurney, E. Condon, 1928. Wave Mechanics and Radioactive Disintegration). Ее авторами были сотрудники Палмеровской физической лаборатории Принстонского университета Рональд Гёрни и Эдвард Кондон. Подобно Гамову, они интерпретировали и очень убедительно объяснили радиоактивный альфа-распад в терминах квантового туннелирования. Правда, в этом тексте, в отличие от статьи Гамова, нет ни одной формулы — авторы аргументируют свои выводы только с помощью графического изображения предложенного ими потенциала силового поля ядра (к тому же, для простоты одномерного). Однако очень быстро они представили свою теорию в подробной и содержащей целый ряд конкретных примеров статье, которую 20 ноября послали в The Physical Review (R. Gurney, E. Condon, 1929. Quantum Mechanics and Radioactive Disintegration). Подобно Гамову, они показали, что из их модели альфа-распада автоматически вытекает установленный в 1911 году эмпирический закон Гейгера — Неттолла, который связывает логарифм периода полураспада радиоактивного ядра с его зарядом (то есть номером этого элемента в Периодической системе) и энергией вылетающей альфа-частицы. В заключительном разделе они подчеркнули, что отказ от классической механики и переход к квантовым принципам позволяет избежать парадоксов при описании экспериментов с рассеянием альфа-частиц на уране, которые тремя годами ранее отметили Резерфорд и Чедвик (E. Rutherford, J. Chadwick, 1925. Scattering of α-Particles by Atomic Nuclei and the Law of Force). Обсуждение этих аномалий завело бы нас слишком далеко, но если вкратце, то экспериментаторы не обнаружили тех различий в рассеянии альфа-частиц различных энергий, которых требовали результаты вычислений на базе ньютоновских уравнений. Гёрни и Кондон в своей второй публикации сослались на статью Гамова в Zeitschrift für Physik и специально подчеркнули, что он пришел к своим результатам совершенно самостоятельно. Так что здесь мы имеем дело с хрестоматийным примером одновременного и независимого открытия. Надо отметить, что, хотя теоретическое объяснение альфа-распада, данное Гамовым и американцами, практически тождественно, в ряде дополнительных деталей их подходы заметно различались. Но это уже тонкости, которые я позволю себе оставить за кадром. Квантовая модель альфа-радиоактивности с началом 1930-х годов получила признание абсолютного большинства специалистов, особенно молодых. Нельзя сказать, чтобы оно пришло мгновенно. Например, сам великий Нильс Бор в ходе международного конгресса по ядерной физике, который состоялся в Риме в октябре 1931 года, высказывал сомнения в адекватности применения квантовой механики к теории ядра. Но и серьезных задержек тоже не было. Уже в 1930 году вопрос о гамовской теории был включен в знаменитый экзамен по математике Кембриджского университета, трайпос, а это говорит о многом. Со временем эту теорию принял и Резерфорд, хотя и с колебаниями. Во всяком случае, он включил свою сателлитную модель альфа-распада наряду с гамовской теорией в фундаментальный труд, который вместе с Чедвиком и Чарльзом Эллисом опубликовал в 1930 году (E. Rutherford, J. Chadwick, C. D. Ellis, 1930 Radiations from Radioactive Substances, стр. 326–333). Но это уже ничего не изменило. Времена классической физики в описании атомных ядер навсегда ушли в прошлое. Заключение19 октября 1937 года Эрнест Резерфорд скончался в Кембридже после неудачного грыжесечения и через несколько дней был похоронен в Вестминстерском аббатстве. Несмотря на ухудшающееся здоровье, он продолжал работать и в 1930-е годы. В это время его сильно занимала совершенно новая для ядерной физики область — создание лабораторных установок для разгона заряженных частиц (в современной терминологии, ускорителей). Думать об этом он начал много раньше. Уже в его большой статье 1919 года содержится мало кем замеченная мысль, что для раскалывания как можно большего числа атомных ядер надо ускорять в лаборатории ионы и альфа-частицы. Он ее повторил 30 ноября 1927 года в президентском послании Лондонскому королевскому обществу, подчеркнув, что «уже давно хотел иметь для исследований обильные источники атомов и электронов, энергии которых сильно превышали бы энергии α и β-частиц от радиоактивных источников». Во исполнение этих планов он помог своим сотрудникам Джону Кокрофту и Эрнесту Уолтону построить линейный ускоритель, эксперименты на котором начались в феврале 1932 года. Эта машина, чьи создатели в 1951 году были удостоены Нобелевской премии, разгоняла протоны до энергий порядка 500 КэВ, что позволило получать пары α-частиц при бомбардировке ядер лития. В 30-е годы эта система ускорения заряженных частиц, спроектированная Уолтоном еще в декабре 1928 года, применялась в лабораториях довольно широко, но лишь для получения энергий до 1 МэВ (в этом качестве ее используют и в наше время).
 Эрнест Уолтон, Эрнест Резерфорд и Джон Кокрофт в 1932 году вскоре после удачных экспериментов на построенном Уолтоном и Кокрофтом линейном ускорителе. Фото с сайта historyofsciences.blogspot.com Резерфорд и сам приложил руку к созданию ускорителей первого поколения. Вместе со своим учеником Марком Олифантом он построил ускоритель ионов, которые там разгонялись в электростатическом поле с разностью потенциалов, доходящей до 250 киловольт. С его помощью Олифант, Резерфорд и приехавший на годичную стажировку австрийский физик Пауль Хартек осуществили целый ряд новых ядерных реакций. Обстреливая разогнанными в этой установке дейтронами тяжелую воду (и, таким образом, сталкивая их с дейтронами мишени), они получили ядра легкого изотопа гелия с массой 3 и сверхтяжелого изотопа водорода с такой же массой — в современной терминологии, трития (M. Oliphant, P. Harteck, E. Rutherford, 1934. Transmutation Effects Observed with Heavy Hydrogen). Правда, выделить эти изотопы в чистом виде они не смогли, это в 1939 году сделали Луис Альварес и Роберт Корног (Robert Cornog), которые также доказали радиоактивность трития (L. Alvarez, R. Cornog, 1939. Helium and Hydrogen of Mass 3). Совместная статья с Олифантом и Хартеком стала последней публикацией Резерфорда с отчетом о результатах нового эксперимента. В последние годы своей жизни он, как и раньше, внимательно следил за исследованиями сотрудников Кавендиша и всячески помогал им в работе советами и критикой. Например, он активно участвовал в спорах о природе нейтрона, открытого Джеймсом Чедвиком в 1932 году. Исторической точности ради не грех напомнить, что концепция нейтрона как равноправной с протоном элементарной частицы окончательно восторжествовала лишь после того, как в середине 1934 года Чедвик и недавний беженец из Германии Морис Гольдхабер (в будущем многолетний директор Брукхейвенской Национальной лаборатории и обладатель американской Национальной медали за научные исследования) точно измерили его массу (в экспериментах по диссоциации дейтронов гамма-лучами) и показали, что она превосходит массу протона (J. Chadwick, M. Goldhaber, 1934. A Nuclear Photo-effect: Disintegration of the Diplon by γ-rays). А величина нейтронного спина дискутировалась еще несколько лет, поскольку данные экспериментов не позволяли решить, равна ли она 1/2, как у протона, или же 3/2. Этот вопрос был закрыт, когда 19-летний студент Колумбийского университета и будущий лауреат Нобелевской премии Джулиан Швингер на основе теоретического анализа результатов рассеяния нейтронов на молекулах орто- и параводорода показал, что спины этих двух частиц одинаковы (J. Schwinger, 1937. On the spin of the neutron). Правда, половинный спин нейтрона и раньше признавался большинством физиков, но в основном потому, что такая гипотеза была проще и логичней своей альтернативы. Однако же физика — наука экспериментальная. Резерфорду очень повезло и в том, что он застал и понял еще два великих открытия в области ядерной физики. Он очень высоко оценил открытие искусственной радиоактивности Ирен Кюри и Фредериком Жолио в конце 1933 года, осуществленное посредством бомбардировки альфа-частицами легких элементов — сначала алюминия, а затем магния и бора. Он также сразу признал исключительное значение объявленного всего через три месяца достижения Энрико Ферми и его сотрудников, которые в марте 1934 года обнаружили возможность искусственного рождения радиоактивных изотопов с помощью нейтронного облучения различных элементов (сначала на мишени из алюминия, потом при бомбардировке других элементов вплоть до урана). Сейчас уже мало кто помнит, что этот эксперимент Ферми задумал для проверки (как оказалось, блистательно успешной) своей теории бета-распада. Она была им развита в самом конце 1933 года и вскоре дополнена его учеником Джанкарло Виком. Резерфорд поздравил Ферми с успехом этого эксперимента в специальном письме, датированном 23 апреля 1934 года. А 1 октября он в качестве признанного патриарха своей науки выступил с обзором ее достижений на Пятой международной конференции по ядерной физике. По интересному совпадению в конце того же месяца Ферми и его сотрудники обнаружили возможность увеличения поперечных сечений ядерных реакций с помощью замедления нейтронов. За эти открытия супруги Жолио-Кюри и Энрико Ферми получили Нобелевские премии — соответственно, в 1935 и 1938 годах. Вряд ли надо напоминать, что работы команды Ферми инициировали последующие эксперименты с медленными нейтронами, которые в самом конце 1938 привели к открытию немецкими радохимиками Отто Ганом и Фридрихом Вильгельмом Штрассманом (при удаленном, но очень важном участии Лизе Мейтнер) цепной реакции деления урана. Под конец хочу лишь напомнить, что ошибочные представления Резерфорда о природе радиоактивности, к которым он пришел в 1920-е годы, ни в малейшей степени не умаляют его величия как экспериментатора и теоретика. А также, добавлю, как поистине замечательного учителя и блестящего организатора науки. Requiescat in pace! Алексей Левин Этот текст войдет в книгу А. Левина «Этюды о частицах: от рентгеновских фотонов до бозона Хиггса»31-01-2024 | Просмотров: 188
Комментарии
Комментировать
Комментировать
|
Ещё по теме
|
|
|